约有40%的糖尿病患者逐渐进展为糖尿病肾病(DKD)。DKD是全球慢性肾脏病(CKD)的主要原因。虽然终末期肾脏病(ESRD)是DKD的主要结局,但是大部分DKD患者未进展至ESRD前,即因为心血管事件或感染而死亡。因此,了解DKD的发病、尽早诊断及及时治疗是减少DKD死亡的关键。
最近,来自美国华盛顿大学Radica Z. Alicic 等对DKD的发病、诊断及治疗进展进行综述,发表在最近一期的CJASN杂志上。
一、DKD的危险因素
| 危险因素 | 易感因素 | 始动因素 | 进展因素 |
| 人口学特征 | |||
| 年老 | + | ||
| 男性 | + | ||
| 种族(黑人、美洲印第安人、拉丁美洲人、亚洲及太平洋群岛人) | + | + | |
| 遗传因素 | |||
| DKD家族史 | + | ||
| 基因性肾脏病 | + | ||
| 系统性因素 | |||
| 高血糖 | + | + | + |
| 肥胖 | + | + | + |
| 高血压 | + | + | |
| 肾脏损伤 | |||
| 急性肾损伤 | + | + | |
| 毒物 | + | + | |
| 吸烟 | + | + | |
| 饮食因素 | |||
| 高蛋白饮食 | + | + |
二、DKD的结构改变
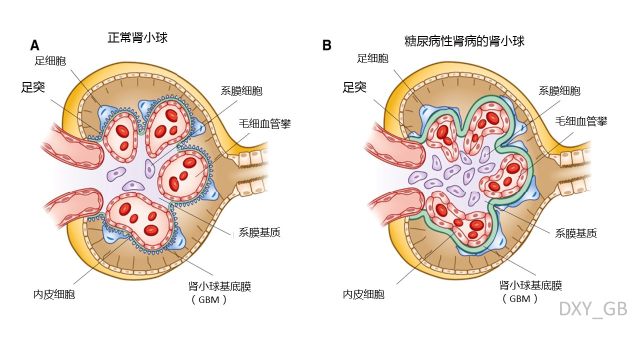
图1. 正常肾脏与糖尿病肾病中,肾小球的形态结构改变
糖尿病性肾病诱导的结构改变包括:肾小球基底膜增厚、足突融合、足细胞丢失、基底膜暴露、系膜基质增多
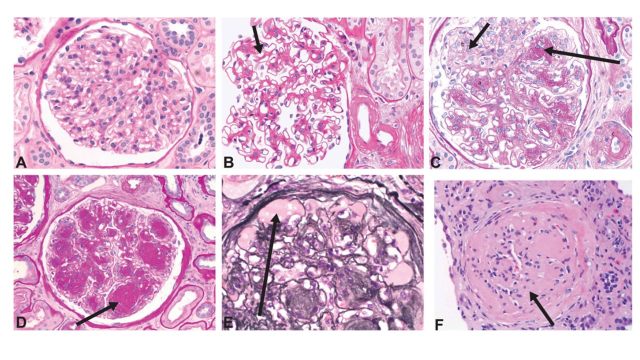
图2 糖尿病肾病中,肾小球组织学的病理改变
(A)正常肾小球; (B)弥漫性系膜区扩张,伴系膜细胞增殖 ;(C)显著性系膜区扩张,伴早期的小结化和系膜溶解;(D)系膜基质形成Kimmelstiel–Wilson小结;(E)毛细血管扩张、形成小动脉瘤伴内皮下玻璃样变; (F)废弃衰退的肾小球
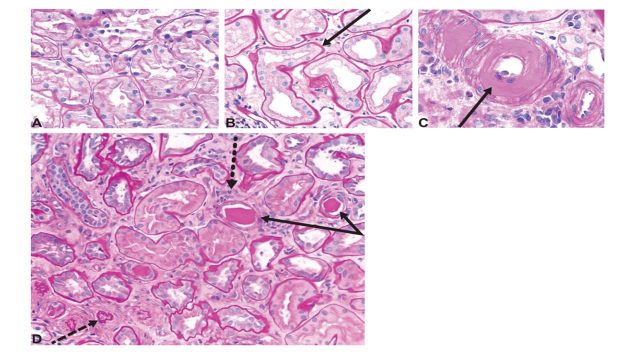
图3 糖尿病肾病的肾小管间质改变和动脉玻璃样变
(A)正常肾脏间质;(B)小管基底膜增厚、间质区增宽;(C)动脉内皮下玻璃样物质沉积、管腔狭窄;(D)糖尿病肾病晚期,肾小球和间质区中,小管基底膜增厚和卷缩(实线箭头)、小管萎缩(虚线箭头)、管型出现、间质增宽、纤维化以及炎症细胞浸润(点箭头)
三、DKD的自然进程
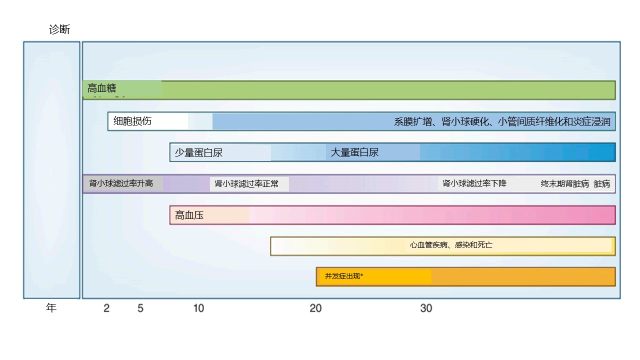
图4 糖尿病肾病的自然病史
*并发症包括:贫血、矿物质代谢紊乱、视网膜病变和神经病变
四、DKD的病理生理改变
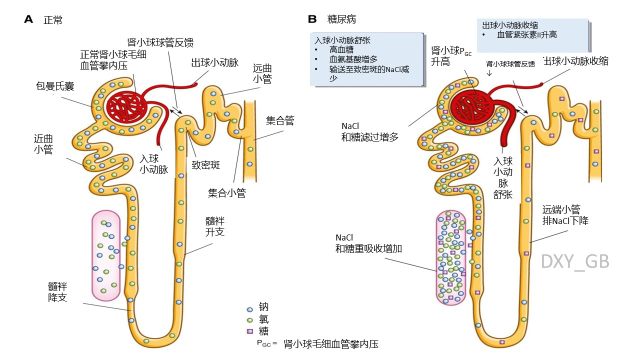
图5 糖尿病肾病的血流动力学改变
五、DKD的诊断
DKD的诊断是基对肾小球滤过率(eGFR)、白蛋白尿和糖尿病病程、糖尿病视网膜病变等临床表现的综合评估。临床上,根据持续性的尿白蛋白肌酐比≥30 mg/g和/或伴eGFR<60 ml/min/1.73 m2而定。
对于1型糖尿病患者,在确定诊断后5年开始进行每年筛查;对于2型糖尿病患者,在确定诊断后需进行每年筛查。 对于有白蛋白尿的患者,有糖尿病视网膜病变强烈提示存在DKD。对于白蛋白尿的检测,推荐使用晨尿的尿白蛋白肌酐比测试。eGFR的估算,CKD-EPI公式可能更为准确。对白蛋白尿或eGFR下降的确认,需要两次检测相隔三个月以上。
六、DKD的治疗
在糖尿病的早期阶段,长期的强化血糖控制有助于减少糖尿病并发症,尤其是DKD的发生。但是,在已存在糖尿病并发症后,强化血糖控制未有证据显示能减少DKD进展或者改善临床结局。研究表明,与标准治疗相比,强化血糖控制HbA1C (6%–6.9%)组未能减少心血管事件或微血管并发症,并增加低血糖风险。
美国糖尿病学会指出,对于糖尿病病程短、年轻、未发生并发症、预期寿命长的患者,强化血糖控制如HbA1C控制在6.5%可能是合适的。相反,HbA1C控制于8%适用于糖尿病病程长、年老、已发生微血管和大血管并发症、预期寿命短的患者。KDIGO 指南指出已有蛋白尿的CKD患者,无论是否合并糖尿病,推荐使用ACE或ARB,将血压控制于130/80 mmHg。
一些新型的制剂有望用于DKD的治疗,如ruboxistaurin(一种蛋白激酶C的制剂)、baricitinib,(一种选择性酪氨酸激酶1和酪氨酸激酶2抑制剂)、pentoxifylline(一种抗炎和抗纤维化制剂)、atrasentan(一种选择性内皮素A受体拮抗剂)finerenone(一种高选择性的非甾体类盐皮质激素受体拮抗剂)。然而,没有一种制剂完成3期临床试验,未经通过可以用于DKD治疗。
未来,患者、医护人员、医疗付费者、科学家、政府决策者等核心成员需要共同合作,为改善DKD患者的健康结局而努力。
