
因多数降糖药物需经过肝代谢转化后发生药效,2 型糖尿病合并肝功能不全患者的口服降糖方案是临床上常见的问题。本文就结合一病例总结及归纳 2 型糖尿病合并肝功能不全患者的口服降糖药应用,供临床医师参考对肝功能不全患者合理选择降糖药物,以提高治疗效果,降低不良反应。
病例简介
患者男,55 岁,因「发现血糖升高 5 年余,血糖控制不佳 2 月余」入院。患者长期皮下注射门冬胰岛素 30 注射液 18 IU 皮下注射 bid(早、晚餐前)联合口服二甲双胍 0.5 g tid 降糖治疗,近 2 个月血糖控制不佳。既往有乙型病毒性肝炎病史。
体格检查:体重质量指数 32.5 kg/m2,神清,体型肥胖,皮肤无黄染,颈静脉无怒张。双肺呼吸音清,未闻及干啰音,心率 75 次/分, 心律齐,各瓣膜区未闻及病理性杂音。腹平软,无压痛、反跳痛,肝、脾肋下未触及,肝区轻叩痛,双肾区无叩痛, 移动性浊音阴性。双下肢无水肿。
实验室检查:空腹血糖 8.2 mmol/L,糖化血红蛋白 9.6%;肾功能正常;肝功能示:ALT 223 IU/L,AST 215 IU/L;乙肝两对半示:乙肝表面抗原阳性,乙肝 e 抗体阳性,乙肝核心抗体阳性,乙肝病毒核酸定量 3.23 × 106 copies/mL。
入院诊断:2 型糖尿病、慢性活动型乙型病毒性肝炎、肝功能不全。
治疗方案讨论
1. 二甲双胍
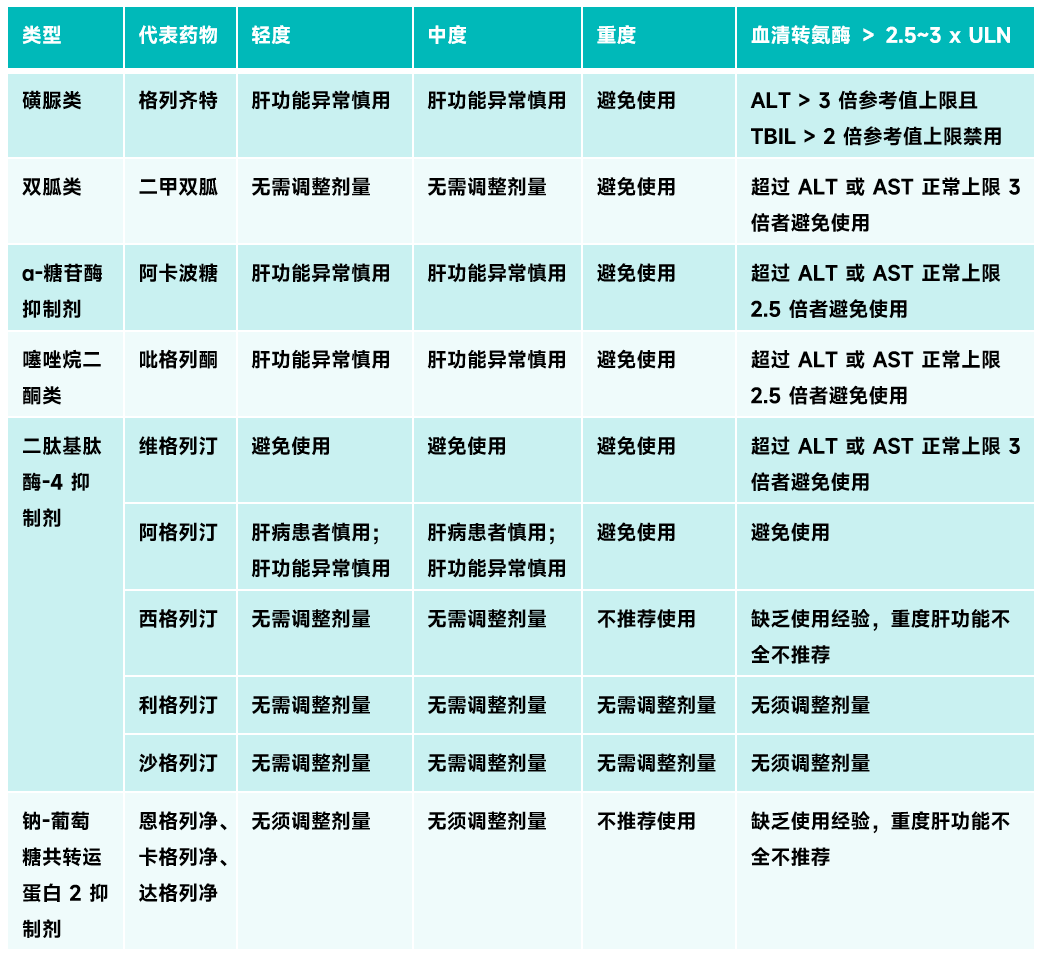
二甲双胍是超重或肥胖 2 型糖尿病患者最常用的口服降糖药物之一,2018 版中国《二甲双胍临床应用专家共识》指出,当患者的血清转氨酶超过 3 倍正常上限时应避免使用二甲双胍 [1]。本例患者入院时肝酶超过正常值上限 4 倍,当肝功能出现异常时,二甲双胍在体内蓄积和发生乳酸性酸中毒的风险增加,故建议停用二甲双胍。
2. 磺脲类药物
鉴于该患者体型肥胖,联合磺脲类药物或增加胰岛素剂量不适用于该患者。
3. 噻唑烷二酮类药物(TZDs)
曲格列酮是第一代噻唑烷二酮类药物,可引起严重的肝脏毒性,包括肝衰竭,且于2000年在被 FDA 撤市 [2]。二代噻唑烷二酮类包括罗格列酮和吡格列酮,其主要不良反应报道较多的是心血管毒性,但于 2009 年有报告表明,罗格列酮和吡格列酮也具有一定的肝毒性 [3, 4]。由于所有的噻唑烷二酮类药物都有导致转氨酶升高风险,因此临床上当患者有活动性肝病或血清转氨酶水平超过正常上限 2.5 倍,应该避免使用该类药物。
4. 钠-葡萄糖共转运蛋白 2 抑制剂(SGLT2i)
SGLT2i 是治疗 2 型糖尿病的新型药物,该类药物不依赖胰岛素,不受胰岛素抵抗和胰岛 β 细胞功能减退的影响,单药治疗或联合其他降糖药均可有效降低血糖,还可以减轻体重、保护心脏和肾脏作用 [5]。
目前我国临床常用 SGLT2i 抑制剂主要有恩格列净、艾托格列净、达格列净和卡格列净,但由于该类药物在重度肝损伤患者中的临床使用经验有限,故该患者不建议使用。
5. 二肽基肽酶 4(DPP-4)抑制剂
胰高血糖素样肽-1(GLP-1)是一种增加葡萄糖依赖性胰岛素分泌的胃肠道激素(肠降血糖素),DPP-4 抑制剂可 GLP-1 活性、减少 GLP-1 的降解,从而增加胰腺胰岛素分泌并控制 2 型糖尿病患者的血糖水平 [6]。
国内上市的有西格列汀、维格列汀、沙格列汀、阿格列汀和利格列汀,其中维格列汀未在美国上市。根据《DPP-4 抑制剂临床应用专家共识》 [7],利格列汀在轻、中度和重度肝功能不全均无需调整给药剂量;沙格列汀在肝功能不全时亦无需调整给药剂量;西格列汀在轻、中度肝功能不全患者中无需调整剂量,但在重度肝功能不全患者中并无用药经验,因此不推荐使用;维格列汀不可用于给药前血清丙氨酸氨基转移酶(ALT)或血清天门冬氨酸氨基转移酶(AST)大于正常值上限(ULN)3 倍的患者;阿格列汀则慎用于肝病患者。
6. 小结
最终,临床医师选择胰岛素联合沙格列汀降糖治疗,患者降糖方案为:门冬胰岛素 28 20 IU ih bid(早、晚餐前)联合沙格列汀 5 mg po qd 降糖。
治疗效果
监测患者血糖情况,患者空腹血糖控制在 6.2~8.5 mmol/L 之间,餐后血糖在 8.0~10.0 mmol/L 之间,血糖控制稳定后转入感染科抗病毒治疗。
总结
目前针对 2 型糖尿病患者的口服降糖药品种类较多,包括磺脲类、双胍类、 α-糖苷酶抑制剂、噻唑烷二酮类、二肽基肽酶-4 抑制剂、钠-葡萄糖共转运蛋白 2 抑制剂等,笔者对常用口服降糖药物在肝功能不全患者中的用法进行了归纳总结,见下表。
常用口服降糖药物在肝功能不全患者中的应用 [5, 8-10]
特别说明 | 本文仅供医疗卫生等专业人士参考
参考文献
[1] 二甲双胍临床应用专家共识(2018年版)[J].中国糖尿病杂志,2019,27(03):161-173.
[2] Rachek LI, et al. Troglitazone, but not rosiglitazone, damages mitochondrial DNA and induces mitochondrial dysfunction and cell death in human hepatocytes. Toxicol Appl Pharmacol. 2009 Nov 1;240(3):348-54.
[3] Floyd JS, et al. Case series of liver failure associated with rosiglitazone and pioglitazone . Pharmacoepidemiol Drug Saf[J], 2009, 18(12):1238-43.
[4] Liang YJ, et al. L-165,041, troglitazone and their combination treatment to attenuate high glucose-induced receptor for advanced glycation end products (RAGE) expression. Eur J Pharmacol. 2013 Sep 5;715(1-3):33-8.
[5] Diabetes mellitus and chronic liver diseases. Literature review (part 2): treatment features. Ter Arkh. 2019 Dec 15;91(12):115-121. Russian.
[6] Mulvihill EE, Drucker DJ. Pharmacology, physiology, and mechanisms of action of dipeptidyl peptidase-4 inhibitors. Endocr Rev. 2014 Dec;35(6):992-1019.
[7]中国医师协会内分泌代谢科医师分会. DPP-4抑制剂临床应用专家共识[J]. 中华内分泌代谢杂志, 2018, 34(11):5.
[8] LiverTox: Clinical and Research Information on Drug-Induced Liver Injury [Internet]. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases; 2012–. PMID: 31643176.
[9] 国家基本药物处方集.
[10] 药品说明书.
