人类在进化史上,长久以来都为食物短缺而挣扎,肥胖原本极为罕见。但几十年来,肥胖的患病率剧增,且越来越多显示出对人类整体健康的不良影响。
针对肥胖的研究
早期对于肥胖病因学和生理学的研究落后于其他疾病,比如糖尿病,部分原因是受限于生理学/生化学研究工具的局限性,特别是在人体学研究方面。
20 世纪的绝大部分大数前沿生物医学研究并未涉及肥胖领域。目前除了一些并无太多作用的饮食建议和副作用较多的药物外,尚无对肥胖安全、有效的治疗方法。
最初针对家庭和双胞胎的研究显示,环境、食物、体力活动和遗传均在肥胖发生中发挥重要作用。
基因对肥胖的作用也在极度肥胖(为常染色显性症状)啮齿类动物中展现出来,其中最为著名、目前普遍用于动物试验的是 ob 和 db 小鼠模型。
直至 1994 年,ob 基因被克隆出来后,科学界对肥胖的认知和发展才得到极大转变,1990 年代兴起的生物科学技术也带动了肥胖研究领域的快速进步,并伴随对细胞生理学调控、激素作用等方面的机制也越来越得到诠释。
瘦素基因的发现与历史纠葛
1. 「饱腹因子」的发现
为 ob 基因克隆奠定科学基础的是 Douglas Coleman 教授,他在 Jackson 实验室建立了 ob/ob 和 db/db 小鼠模型;在这之前 Jackson 实验室对引起食欲过盛、极度肥胖动物的常染色体显性疾病做了深入研究。
Douglas Coleman 教授的实验结果表明引起 ob/ob 小鼠肥胖的原因是血循环内缺少「饱腹因子」,而引起 db/db 小鼠肥胖的原因则是对饱腹因子无法产生反应。
但基于当时的技术无法鉴定出这一含量极低的饱腹因子,因此这一结论未得到科学界的完全信服。
但 Jackson 实验室仍然为一些感兴趣的学者提供肥胖模型,很多研究明确了这些动物的生理学特征数据,直到 ob 基因被克隆出来前已经有超过 1000 篇的学术论文发表。
2. 被命名为「瘦」的基因
1986 年,洛克菲勒大学鉴定出了 ob 基因,以基因学的视角和技术研究疾病的方式才开始兴起。最初的研究采用候选基因方法,对已知信号通路上的可疑基因进行测序。
通过无偏基因鉴定方法和测绘技术从人类与小鼠中探寻某些连锁基因。但对于某些遗传性疾病特定基因的发现,当时的学者也无法确信。最初的项目研究需要研究者对课题的热情、实验技术、硬件资源、长期合作和一定的金钱才能开展。
最终鉴定出 ob 基因的文章发表在 1994 年 12 月的 Nature 杂志,洛克菲勒大学的 Friedman 和 Leibel 教授因此获得了国际赞誉。后续发表在 Science 的文章中命名了这一基因为 leptin(来自于希腊语,意为瘦),并使用重组瘦素纠正了 ob/ob 小鼠的肥胖症状。
3. 瘦素基因发现的历史纠葛
引发争议的是,只有 Friedman 教授是上述两篇重要文献的主要和通讯作者,但 Leibel 教授从未公开提出异议,也因此逐渐被人忽略掉他对 ob 基因克隆的贡献。
之后有很多言论探讨了对这一科学贡献的名誉问题,而在 1993 年两位教授也结束了合作。
后续 Friedman 教授独自主导了一系列实验,包括上述发表在 Science 的文章,这项研究也成为 ob 基因作用于肥胖发生的确据,即 ob 基因实际上编码了一种脂肪细胞激素,对调节食欲和体重非常具有必要性。
之后很多科学界大奖通常会将 Coleman 教授和 Friedman 教授作为共同获奖者,包括 Shaw Prize、the Gairdner Award 以及 Lasker Award 等,而 Leibel 教授的贡献似乎已经被彻底遗忘。
毋庸置疑,Friedman 教授和 Leibel 教授在 ob 基因研究上都具有不同凡响的眼光、技术、头脑和勤奋,虽然最后存在分歧。
Friedman 教授后来成为洛克菲勒大学实验室的领导者,而 Leibel 教授则离开去往了哥伦比亚大学,主攻领域改为儿科疾病分子遗传学,同时也是 Berrie 糖尿病中心主任以及纽约肥胖研究中心主任。很多人质疑 Friedman 教授的做法,但客观历史如今已经很难说清。
同时,很多关于瘦素的科学问题也尚未得到完全阐明,甚至越来越多。从 1995 年至 2017 年共发表相关文献超过 33000 篇,仅 2017 年已经达到 2200 篇。
瘦素的治疗作用
1. 肥胖
虽然从一开始瘦素就被寄予了治疗肥胖的厚望,但事实并非如此。因为很少有肥胖患者为瘦素基因突变所致功能缺失,只有这类患者会对瘦素补充治疗产生明确而显著的效用,即快速降低食欲和进食量并达到减重的目标。
然而实际上,瘦素基因完全缺陷的肥胖患者极其罕见(全球约仅有 25 例),而对于普通的肥胖瘦素补充治疗没有效果。
相反,通常的肥胖患者血循坏内瘦素水平是升高的,且与肥胖程度呈正比;在代谢性手术后肥胖患者的瘦素水平可大幅降低,且降低幅度与能量消耗抑制呈正比。
这一点很像 2 型糖尿病患者,由于存在胰岛素抵抗,胰岛素水平不是下降而也是升高的。但虽然存在胰岛素抵抗和高胰岛素血症,胰岛素仍然可以降糖,因此很多研究者认为补充瘦素同样可能减重及用于肥胖相关糖尿病,即使已经存在高瘦素血症状态。
然而,在高脂饮食诱导的肥胖小鼠模型中,注射瘦素并未产生显著减重效果;而 Amgen 公司开展的临床试验也未显示出对肥胖患者的治疗效果,因而也放弃了瘦素的继续研发。
有没有可能对于那些血循环中相对较低瘦素水平的肥胖患者,即部分性瘦素缺乏症,对瘦素补充治疗有效呢?
印度一项关于肥胖的纵向研究中,在 2 年内有些患者体重继续增加,有些患者则无显著变化,体重继续增加的患者其血循环瘦素水平较低,符合上述假设,对于这类患者瘦素补充治疗可能有效。
而 Amgen 公司 20 年前的临床研究在重新分析后发现,那些瘦素水平在最低 10th 百分位数区间内的肥胖患者相对于安慰剂组可从瘦素补充治疗中获益,减重程度与瘦素缺乏程度密切相关。
上述这些发现认为,使用瘦素类似物或瘦素受体激动剂可能对低瘦素水平肥胖患者具有一定治疗作用,尽管这类患者占比较低,但全球肥胖人群越来越庞大,仍有研发价值。
2. 脂肪代谢障碍
另外一些研究发现,脂肪萎缩而非脂肪过量患者可从瘦素补充治疗获益。
脂肪代谢障碍是一种相对比较少见的疾病,由于脂肪萎缩导致血循环内瘦素水平降低,而脂肪缺乏和低瘦素水平可促进代谢功能紊乱,包括高甘油三酯、严重脂肪肝、胰岛素抵抗,大部分患者糖耐量受损。瘦素补充治疗对脂肪代谢障碍具有显著代谢获益,目前已被 FDA 获批这一适应症。
3. 糖尿病
对于伴有肥胖的新诊断 2 型糖尿病患者,瘦素治疗 2 周未对脂肪含量或糖代谢/胰岛素敏感性产生获益。
但在 1 型糖尿病小鼠模型中,瘦素反而能够降低血糖,且独立于胰岛素作用。可能是机制为,瘦素能够抑制糖原分解,并拮抗下丘脑-垂体-肾上腺轴作用。
但在 1 型糖尿病患者中,瘦素类似物治疗 12~20 周未产生降糖作用,但对体重和胰岛素用量有一定获益。
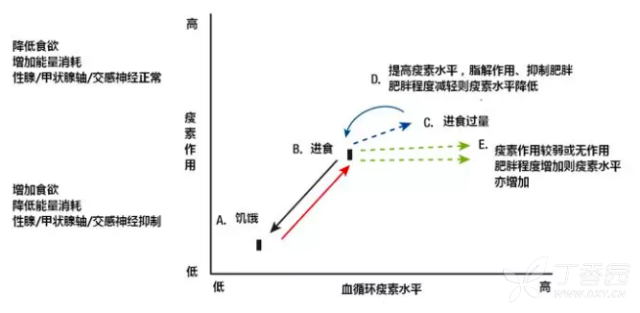
图:瘦素作用生理学机制图
在(A)限制食物或饥饿状态时,低瘦素水平可促进食欲,降低能量消耗,抑制下丘脑-垂体-性腺轴/肾上腺轴以及交感神经系统功能活性。在(B)进食后,饥饿感消失,交感神经系统兴奋,下丘脑-垂体-性腺轴/肾上腺轴功能恢复。
在(C)进食过量时,可能出现两种瘦素反应模式:(D)增加瘦素水平可发挥其脂肪分解作用,并通过下丘脑中枢进一步抑制食欲和/或提高交感神经活性,达到减重效果,此时瘦素水平降低。
(E)更常见,瘦素水平随肥胖程度进一步升高(瘦素作用已经饱和),瘦素抵抗状态加重,作用甚微或无法发挥抑制食欲、提高交感神经活性作用,也就无法起到减重效果。
总结述评
距瘦素被发现已经 24 年,大量的学术研究阐释了瘦素在糖脂代谢、进食/饥饿、能量调控方面的潜在作用机制。
但瘦素的临床应用之路不像胰岛素那样平坦、简单,到目前为止其临床价值远远没有体现出来。
除了对极其罕见的瘦素缺乏症和较为少见的脂肪代谢障碍患者有明确而显著的作用外,对于通常的肥胖、糖尿病等均难以产生治疗效果。
然而,科学界并没有放弃对瘦素及其相关激素、调控机制更加深入的探索,或许在不久的将来,对于瘦素所涉及的中枢代谢通路将得到更全面、更明确的解读,最终可以应用于全世界日益泛滥的糖脂代谢性疾病。
