8 月 10 日,来自耶鲁大学医学院,暨南大学,斯坦福大学的研究人员发表了题为「m6A mRNA methylation controls T cell homeostasis by targeting the IL-7/STAT5/SOCS pathways」的文章,首次报道了 m6A mRNA 修饰在哺乳动物免疫细胞中的生理功能。该项研究发现,m6A 通过靶向 Naive CD4 T 细胞中 IL-7/STAT5/SOCS 信号通路中的信号分子 mRNA 来调控 Naive CD4 T 细胞的分化,从而维持免疫系统的动态平衡。METTL3 作为重要的甲基转移酶调控 m6A RNA 甲基化修饰,在 CD4 T 细胞中特异性敲除 Mettl3 基因,Naive CD4 T 细胞的分化受阻,从而抑制了 T 细胞过继转输诱导的肠炎模型中肠炎的发生。该项研究首次揭示了体内 m6A 甲基化修饰在 T 细胞介导的肠炎中的生理功能,为 T 细胞体内稳态和信号依赖的 mRNA 的降解提供了新的分子机制。
这一研究成果公布在 Nature(IF = 40.137)杂志上,文章的通讯作者分别是暨南大学***尹芝南教授,耶鲁大学医学院 Richard A. Flavell 教授,以及出生于台湾的斯坦福大学首席研究员 Howard Y. Chang。
m6A(N6-腺苷甲基化修饰)是 RNA 中最丰富、分布最广泛的 RNA 修饰。2011 年,m6A RNA 去甲基化酶 FTO 的发现,让人们重新开始关注 RNA 甲基化修饰在生理上的作用。近期研究发现,在胚胎干细胞(ESC)中敲除 m6A 甲基化酶 METTL3 后,在诱导分化条件下,ESC 仍持续高表达多潜能相关基因(Oct3/4、Nanog、Rex1),无法上调分化相关基因 (Gata6、Sox1、Otx2 等) 的表达,使 ESC 一直处于多潜能化阶段。与 ESC 分化类似,Naive T 细胞可在体内/外特定分化条件下分化为不同的 T 细胞亚群,但 m6A 在 T 细胞稳态和分化中的作用仍然未知。
在这项研究中,研究人员通过构建 CD4-Cre Mettl3fl/fl 条件性敲除小鼠(以下简称 KO 鼠)系统性地研究了 N6-腺苷甲基化修饰调控 T 细胞稳态的分子机制。该研究发现,分选的 Naive CD4 T 细胞在体外相应的细胞因子诱导下,KO 小鼠来源的 Naive T 细胞分化为 Th1 和 Th17 细胞的比例显著下降,分化为 Th2 细胞的比例显著上调,而 Treg 细胞比例几乎没有变化。且在将 KO 小鼠 CD4+CD25-CD45RBhi Naive T 细胞转输至 RAG2-/-小鼠体内后,无法诱导小鼠慢性肠炎。对转输至 RAG2-/-小鼠体内的细胞进行分析发现:1)KO 小鼠 Naive T 细胞可在 RAG2-/-小鼠体内长期存活(至少 12 周);2)转输的 KO 小鼠 Naive T 细胞无法进行稳态增殖和分化,始终维持 Naive T 细胞状态 (图 1) 。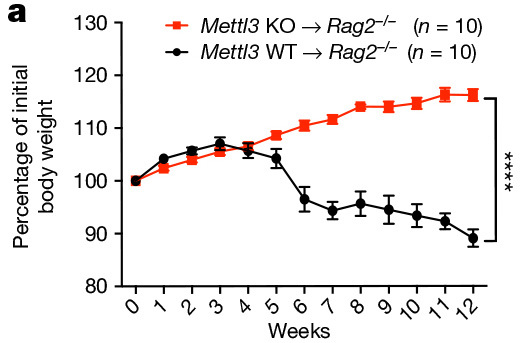
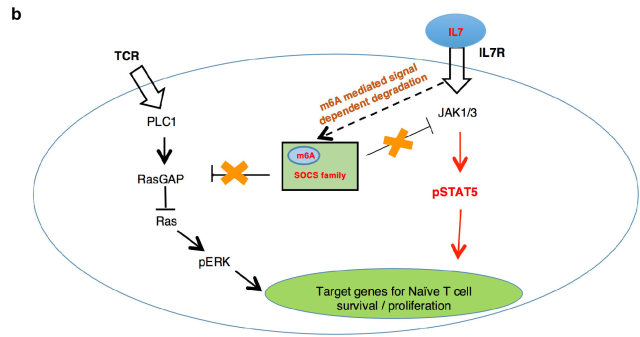
图 1. Mettl3 KO Naive T 细胞转输至 RAG2-/-小鼠体内不会导致自发性肠炎(a),继续保持初始状态,无法进行稳态增殖(b)。
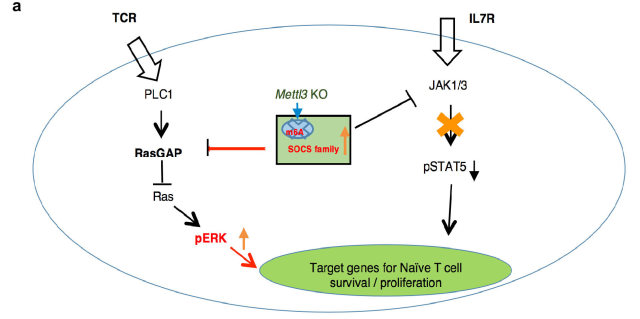
Naive T 细胞的稳态和存活主要受 IL-7/STAT5 和 TCR 信号通路共同调控。因此,METTL3 的敲除可能影响了 IL-7R 下游信号分子,从而影响了转输的 T 细胞的增殖和分化。为了验证这一猜想,分选的 WT 和 KO 小鼠的 Naive T 细胞体外给予 IL-7/IL-2 或 anti-CD3/CD28 刺激,实验结果表明 KO 小鼠 Naive T 细胞的 IL-7 信号通路下游的 JAK1 和 STAT5 磷酸化水平显著降低,而 TCR 下游信号分子 ERK 和 AKT 的本底磷酸化程度增强。进一步研究发现,KO 小鼠 Naive T 细胞中,一类细胞因子信号抑制分子(SOCS)家族的 mRNA 水平显著上调,这其中包括 SOCS1、SOCS3、CISH,而这些蛋白是已知的 IL-7 信号抑制分子,其中 SOCS1 还可抑制 Ras-GAP 的活性, 从而促进 ERK 和 AKT 的磷酸化。上述结果揭示了为何 KO 小鼠 Naive T 细胞无法稳态增殖却可以长期存活,同时也表明,m6A 可靶向 SOCS 蛋白家族,调控 IL-7 和 TCR 信号通路,影响 Naive T 细胞的稳态增殖和分化。
有研究表明,大部分基因(~87%)的 mRNA 丰度的变化主要是由 mRNA 的转录速率决定的,但小部分基因(~13%)的 mRNA 丰度是由降解速率决定。这一小部分基因主要为早期快速诱导基因,而 SOCS 家族的大部分成员属于 IL-7 刺激诱导的早期快速诱导基因。然而,T 细胞中的 m6A 其如何选择性靶向 SOCS 蛋白家族呢?通过 RNA 降解试验以及全基因组测序的 s4U-Seq 试验发现: 1)IL-7 可诱导 SOCS mRNAs 的快速降解,解除 SOCS 家族蛋白对 IL-7 受体信号通路的抑制作用,促进 Naive T 细胞重编程(Reprogram)进而启动 T 细胞的增殖、分化;2)m6A 介导了一类基因(包括 SOCS 基因)mRNAs 的快速降解(图 2)。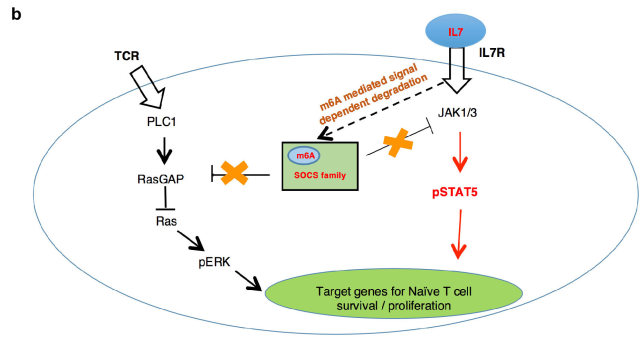
图 2. m6A 控制 T 细胞稳态分布的分子机制。 a. Mettl3 KO 初始 T 细胞内的 Socs 基因表达升高阻止了 IL-7 诱导的激活;b. 初始 T 细胞激活的新模型。
机体内 T 细胞的稳态为机体免疫监视和免疫防御提供了重要保障。该项研究首次揭示了体内 m6A 甲基化修饰在 T 细胞介导的肠炎中的生理功能,阐明了 m6A 甲基化修饰在调控辅助性 T 细胞的效应分化中的作用,为 T 细胞体内稳态和信号依赖的 mRNA 的降解提供了新的分子机制,并且表明 m6A RNA 修饰系统可以作为减轻自身免疫疾病的药物靶点。
作者简介:
尹芝南教授 1988 年获得上海第二医科大学免疫学硕士学位,1997 年获得德国柏林自由大学博士学位。同年赴耶鲁大学医学院风湿科从事博士后研究,2006 年晋升为副教授,获得耶鲁大学内科系科研成就奖。2007 年起被聘任为南开大学生命科学学院院长,同年被评为国家杰出青年基金获得者,并以首席科学家身份担任科技部重大科学研究计划。2008 年被评为教育部「***」特聘教授。2013 年被引进到暨南大学筹建生物医学转化研究院并出任院长,主要研究方向为γδ T 细胞的分化发育及其在肿瘤免疫、肝炎和肠道菌群调控中的作用,共发表文章 96 篇,其中以通讯或共同通讯作者发表文章 47 篇。
赛业生物非常荣幸成为尹芝南教授课题组的合作伙伴,为其提供模式动物小鼠定制服务。赛业生物拥有 11 年模式动物技术服务经验,学术引用累计超过 1300 篇,并已服务数万客户。为了给追求速度和效率的科研学者提供更快捷高效的服务,现正式推出「万例 CRISPR-AI 敲除小鼠精子库」——超 3800 例现货库存,仅需 2.38 万,最快 7 周即可拿到阳性小鼠。详情可拨打 400-680-8038 或邮件至 info@cyagen.com 咨询。
